患者故事
郑嫒一直致力于公益管理的深入学习,如今的她怀揣着爱与希望带领着紫贝壳公益,一直走在罕见病治愈的路上。
我们非常重视您的个人隐私,当您访问我们的网站时,请同意使用的所有cookie。有关个人数据处理的更多信息可访问《隐私政策》

2022-2023年对于全球制药行业来说是比较有挑战的年度,但从美国FDA 2023年批准上市的55个创新药数量来看,已是过去十年以来FDA批准数量第二多的年份,其中不乏一些是中国的Biotech开发的产品,可见药物研发的机遇和挑战是共存的。精鼎医药分析近年来影响药品上市的众多因素时,认为赛道的选择应该是未来国内企业做国际开发时需要重点考量的因素。前国家药监局专家,精鼎医药法规战略咨询部张明平先生针对药物临床研发中的策略为业界同仁分享相关经验和案例。
中国医药行业经历了数十年的变革,从最初以仿制药为主,到采用"Fast follow"(快速跟进)策略,再到如今越来越多地参与创新药研发。这一演变过程不仅体现了中国企业研发能力的显著提升,也标志着它们已具备开发更具创新性产品的能力。基于我在精鼎医药协助国内企业走向国际市场的咨询经验,我认为在当前阶段,中国企业在选择研发赛道或具体适应症时,需要更全面地考虑科学、法规和商业前景等因素。
从2020年至2022年药品审评中心发布的年度报告中可以看出,研发立题问题连续多年被列为药品注册申请的首要问题。这包括对产品临床价值评估不足、适应症选择欠合理、临床定位不清等。这些反馈实际上是监管部门向企业传递的明确信号,强调了合理选择研发方向的重要性。此外,业内分析也指出,国内生物科技公司的研发管线同质化问题严重,难以凸显自身优势和开发差异化产品,导致企业估值不佳或面临融资困境。因此,从法规和市场竞争的双重角度来看,制药企业必须高度重视适应症的选择。

图1 药品审评中心年度报告
选择适应症是药物开发策略中的关键决策,它不仅影响产品的开发方向,还直接关系到未来的市场前景和商业成功。根据一篇文献的总结图(图2)1,评估未被满足的临床需求应从三个主要维度考虑:替代疗法的有效性、疾病严重程度和患者人群特征。这三个要素在不同利益相关方眼中的重要性各不相同。例如,监管机构可能更关注疾病严重程度,而医保机构则可能更看重患者人群规模。企业通过对这些要素进行深入调研和分析,可以明确产品的适应症定位、制定合适的开发策略,并为与各方利益相关者的沟通奠定基础。这种全面的评估有助于企业在与药监机构、医保报销机构以及投资人等进行交流时更加有的放矢,提高沟通效率和成功率。
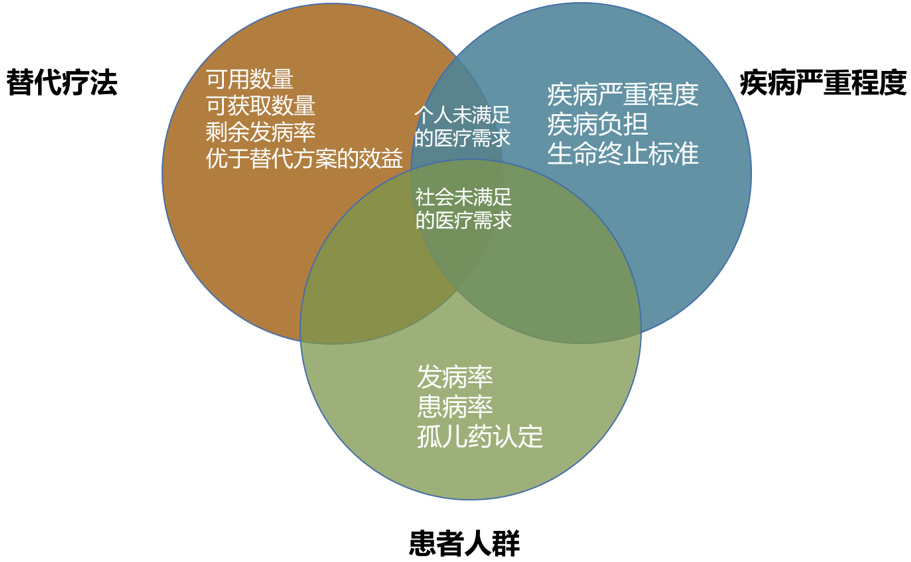
图2 未满足的临床需求定义的3个基本元素集
从药监机构的角度来看,适应症选择的合理性和急需性评估至关重要。2023年,中国CDE发布的《新药获益-风险评估技术指导原则》(2023年第36号)与美国FDA的类似指南相呼应,为全球药物开发提供了重要参考。根据这一指导原则,在阐述适应症的合理性时,应全面考虑治疗背景、获益情况、风险管理情况及风险获益结论。值得注意的是,企业在阐述获益风险情况时,往往侧重于产品的临床获益,而对风险的阐述不够充分。然而,从监管机构的角度来看,充分、深入地阐述风险及相应的管理计划,不仅表明企业对产品有深入理解,也能增强监管机构对企业进一步开发产品的信心。
从商业角度考虑,高商业价值的产品通常是临床疗效排名前三或首先进入市场的前三名。研究2显示,具备这些特征的产品通常能获得较好的商业收益,而后进入市场且无明显药效优势的产品,市场份额可能很有限。对于既非药效最佳也非最先上市的产品,企业可以考虑从有效性、安全性和患者顺应性方面进行差异化。如果这些方面都难以实现显著优势,企业还可以考虑更换赛道,探索同靶点的其他适应症,或调整目标市场,如从美国转向欧洲、日本、中国或东南亚等地区。这些策略最好在项目初期就纳入整体规划,以便更好地把控整个开发流程和进程。通过综合考虑监管要求和商业策略,企业可以更精准地选择适应症,制定全面的开发计划,从而在激烈的全球医药市场中占据有利地位。
一个好的产品开发策略首先企业要审慎制定开发目标,这决定了整个开发策略的方向。根据精鼎医药的经验,制定目标时需要考虑以下几个关键方面:首先, 要对目标人群的诊断现状进行调研,这有助于评估目标适应症的诊断难点,提高临床试验受试者的招募效率。例如目标适应症为患者数量较少的罕见病,这类疾病较难诊断,罕见病相关协会有过调研,有60%~70%的医务工作者不了解罕见病3,也就是有相当一部分罕见病患者无法被及时诊断出来;其次,深入调研了解目标患者人群的治疗现状,包括临床标准治疗方法和患者接受治疗的比例。例如, 乙肝患者中有相当一部分未接受治疗,这可能影响临床试验的招募。同时,要充分理解现有治疗的痛点,分析患者选择新产品的可能性。第三,评估开发的难易程度,如治疗时间长达五年才能达到临床终点的药物可能带来的高成本和长周期。第四,考虑目标适应症在法规上的优惠和先例,因为任何监管挑战都可能影响开发的成功率、时间和成本。最后,评估目标适应症的潜在商业价值,确保产品和公司的可持续发展。总的来说,制定开发策略时需要从时间、成本和成功率三个基点出发,综合考虑各种内部和外部因素,制定恰当的策略。这种全面的考量不仅能提高产品开发的成功率,还能优化资源配置,增强企业在全球医药市场中的竞争力。
影响适应症选择和开发策略制定的内部因素主要涉及三个方面:药学、药理毒理和临床。在药学方面,企业需要评估其研发能力和产品质量是否符合ICH要求,以及质量管理是否满足目标区域的标准。例如,开发针剂产品时,需要考虑中国即将加入PIC/S带来的影响,可能需要执行比当前国内GMP更高的欧盟无菌制剂标准。若计划在美国申报上市,则需要评估自身或CDMO企业的CMC能力是否能满足美国对生物制品最严格的GMP要求。在药理毒理方面,关键是评估所选适应症是否有合适的动物模型支持。对于前沿的细胞和基因治疗产品,由于可能缺乏合适的动物模型,可能需要与监管机构进行深入沟通,确定支持首次人体试验所需的药理毒理数据。此外,还需确保产品的临床前研究符合目标区域的法规要求,以及相关CRO研究机构的质量体系是否达标。在临床方面,企业需要评估自身是否具备管理全球开发的能力,包括适应症的选择、与主要研究者的关系、患者的招募效率等。这些内部因素都是制定开发策略时需要深入考虑的关键点,它们直接影响产品开发的可行性、效率和成功率。
影响开发策略制定的外部因素有法规、临床和市场三个方面。在法规方面,中国的药企难以全面掌握全球各国或地区的详细法规要求,因此借助CRO的力量可成为一个高效的解决方案。通过CRO,药企可以深入了解目标市场的临床试验和上市申报的具体要求,以及当地法规层面的优惠加速政策。这包括评估获得快速通道、突破性治疗认定以及优先审评的可能性,从而加快产品的开发进程。在临床策略方面,全球开发需要考虑不同国家或地区的人种差异和临床实践的不同。同时,还应评估临床试验实施的经验和环境,以实现快速且成本效益高的全球开发。例如,通过借助外部力量,企业可以了解目标国家的临床研究中心、主要研究者在临床试验质量和速度方面的历史表现,从而做出更好的决策。市场层面,企业需要以产品上市为最终目标,考虑目标市场的准入机制,为后续的商业化措施做好布局。通过深入理解和分析这些外部因素,企业可以制定更加精准和有效的全球开发策略,最大化其产品在国际市场的潜力。
下表提供了一个简单而全面的评估体系,通过技术可行性、临床开发考量、法规考量以及商业前景几个维度对适应症选择和开发策略进行综合评估。从科学角度来看,技术可行性是首要考虑因素。已在临床上证明成功的药物作用机制,如快速跟进模式的同类型药物或同机制不同类型的分子,其开发成功的可能性较高。相比之下,仅有临床前动物模型证明的作用机制风险较高,而完全未经验证的机制则风险最高。
临床开发考量方面,无药可用的适应症通常能获得研究者和监管机构的大力支持,临床试验规模较小,进展相对较快。反之,对于临床规模大、概念未经验证或临床终点不明确的情况,开发难度会显著增加。法规考量角度需要评估产品是否符合加速审批途径的要求。符合条件的产品可在审评时限、沟通交流和指导等方面获得监管机构的额外支持,这可能会显著加快开发进程。最后,商业角度的考量涉及市场规模、市场渗透率以及整体商业价值。这些因素直接影响产品的长期盈利能力和公司的可持续发展。
通过这个多维度的评估体系,企业可以更系统、全面地评估不同适应症和开发策略的可行性和潜在回报。这种方法不仅有助于识别最具潜力的开发机会,还能帮助企业更好地分配资源,平衡风险和收益。
表1适应症选择评估表
标准 | 1 | 2 | 3 | 4 | 5 |
技术可行性(科学原理和概念验证) | 未开发或未验证MoA* | 体外数据和体内模型支持MoA | 与化合物相关的分子现有临床数据支持MoA | 与化合物相似的分子有临床支持MoA | MoA的临床数据已获得 |
临床开发考量 | 需要获得人体PoC**数据 | 以下三个标准中满足任意一个: 1)临床规模小于100,或有明确的目标人群 2)临床试验到达终点时间<1 年 3)有明确的临床终点 | 以下三个标准中满足任意两个: 1)临床规模小于100,或有明确的目标人群 2)临床试验到达终点时间<1 年 3)有明确的临床终点 |
|
|
法规考量 | 无法规优惠 | 优先审评审批 |
|
|
|
商业前景 | 市场规模和渗透率等 | ||||
*Mechanism of action,作用机制
**Proof of concept,概念验证
前面提到, 在全球药物开发策略制定中,开发时间、成本和成功率是三个关键考量因素。精鼎医药凭借其丰富的国际经验,能够帮助企业在这些方面做出最优决策。开发时间评估需要综合考虑法规要求和临床执行效率。在法规方面,各国要求差异显著:中国和美国要求提交完整CTD资料,准备时间较长;欧盟和澳大利亚的要求相对简化,以临床方案、研究者手册和知情同意书为主,其中澳大利亚资料准备最为简便。审评审批时间也各不相同,澳大利亚采用备案制仅需7天(但伦理审批约需2个月),美国IND为30天默示许可,而中国和欧洲IND审批约需3-4个月。临床执行效率方面,则需考虑患者招募速度、临床运营效率、试验设计创新性等因素。成功率评估主要从监管认可度和临床运营两方面考虑。监管策略上,创新性试验设计(如统计模型模拟减少剂量组)需提前与监管机构沟通。对于基因和细胞治疗等创新产品,建议考虑在美国FDA申请临床试验,以获取更多指导。临床运营方面,需评估试验难度(如ADC药物的I期试验较为复杂),并选择有经验的临床研究中心和CRO团队。
综合考虑以上多方面因素,企业需要为其产品选择合适的适应症、国家和地区组合。在评估不同组合的开发成本时,可以借鉴精鼎医药丰富的海外开发经验和案例数据库。精鼎医药拥有专门的海外临床研究评估团队,能够全面分析开发成本、效率等因素,为药企提供量身定制的解决方案和开发计划。基于这些评估,企业可以优化开发成本,选择最适合自身产品的开发策略和适应症组合。精鼎医药的专业团队能够综合考虑各方面因素,为企业管理层提供决策依据,从而提升项目成功率,加速创新药物的全球化进程。
1Unmete Medical Need: An Introduction to Definitions and Stakeholder Perceptions, Value in Health, Vol 22, Issue 11, Nov 2019, Pages 1275-1282
2The trend and Challenges of China Pharm. Innovative drug going global,BCG report,2022
3《2020中国罕见病综合社会调研》北京: 人民卫生出版社, 2020.
点击观看研讨会回放视频:策略和质量 – 成功进行全球开发的基石,了解更多相关内容。