患者故事
郑嫒一直致力于公益管理的深入学习,如今的她怀揣着爱与希望带领着紫贝壳公益,一直走在罕见病治愈的路上。
我们非常重视您的个人隐私,当您访问我们的网站时,请同意使用的所有cookie。有关个人数据处理的更多信息可访问《隐私政策》
早期开展注册路径规划和与监管机构的沟通对您的开发工作至关重要,它能够起到保驾护航的作用,帮您规避错误并使您的产品获得更大几率的成功。我们的团队成员有很多曾在监管机构参与过审评工作,因此深入了解监管机构将如何评估您的计划。他们将充分利用过往工作经验帮您解读指导方针,以发挥您的资产开发计划的潜力。
在开发过程的关键时刻,我们会帮您把控好注册路径,降低合规风险,从而简化和加快您产品的上市历程。我们提供支持的领域包括:
综合产品开发规划:将药物开发的关键组成部分,包括非临床、CMC、临床、医学、法规和市场准入战略,整合到一个统一的计划中。整合这些关键要素可减少延误、提高效率、加强不同团队和利益相关方之间的协调。
与监管机构的沟通:多与各国监管机构展开早期沟通是非常必要的,我们可为这些互动提供战略性的支持。我们会帮助您制定与监管当局的沟通策略,以满足他们的期望和要求。我们的专业洞见和协作模式将助您与监管机构开展自信而有效的沟通。
方案优化:考虑所有利益相关方的数据需求,包括患者、监管机构和支付方。通过对研究方案的调整,我们可帮助您提高数据质量,让决策变得更加高效,让开发过程变得更加顺畅。经我们优化的方案不仅能为患者提供有意义的临床结果,还能满足监管机构和支付方的期望。
首次高质量的监管文件提交:提升首次提交的质量,确保提交资料的准确性和完整性以增加及时获批的机会。这个方法对于让监管机构与您保持积极的接触和形成良好印象至关重要。
GxP核查的准备工作:来自前监管机构的团队成员曾多次参与美国FDA以及其它监管机构的全球现场核查,因此我们非常了解您的工厂所需要满足的所有要求。我们会积极帮助您开展迎检准备工作以更大限度地降低可能发现的不合规问题或情况的风险,要知道这些问题可能会干扰您的运营或导致产品审批的延迟。
外包:为了帮助客户公司提高效率和资源的可用性,同时最大限度地提高产品的投资回报率,我们推出了外包服务。我们的团队可提供全球注册、功能性服务(如CMC)以及全球范围内的运维活动服务,从而帮您解放内部资源,将专业力和注意力转向战略需求领域。这种资源的战略分配可推动创新和长期目标的实现,同时帮助您的产品在国际市场上获得更高的知名度和接受度,并在所有市场中遵守当地法规。
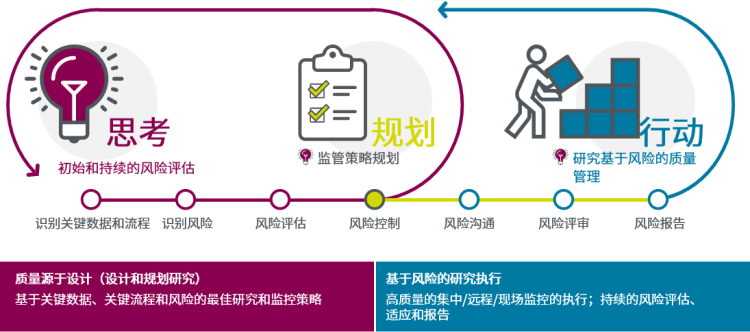
在基于风险的质量管理服务(RBQM)的原则驱动下,可以在潜在风险升级为实际损失之前的最早阶段识别、捕获和管理数据质量问题。这一方法将研究的风险评估、复杂性、所在国法规要求、研究中心监测和能力作为关键考量因素,为构建符合目的的监测战略奠定了坚实基础。
从产品临床开发的早期阶段到获批上市,再到生命周期内的维护,精鼎医药由1,000多名法规专家(包括80多名曾在监管机构任职的官员)组成的团队可为您提供专业知识、完善的系统和有技术支持的流程,帮助您加快和简化医药产品的开发过程。凭借我们在110多个国家/地区端到端的专业知识和经验,我们可为客户提供战略性的法规建议,预测和管理风险,应对频繁变化的监管挑战。
The Regulatory Navigator
想了解我们的专家对行业最新话题的见解吗?欢迎访问我们的精鼎洞见中心,阅读、观看和收听相关内容。